
血小板输注是预防和治疗因血小板数量减少或功能异常导致出血的重要手段,但反复输注血小板会导致免疫性血小板输注无效(platelet transfusion refractory,PTR)。PTR表现为2次连续输注足量随机ABO同型血小板,或者在2周内3次输注血小板均未能达到预期结果:即预防性输注的输后1小时血小板计数校准增加值(1h-CCI)<7.5或24-CCI<4.5、治疗性输注时未达到止血效果等。
引起PTR的原因有非免疫性因素、免疫性因素、混合因素。非免疫性因素主要包括感染、发热、脾肿大、出血、DIC、某些药物(如抗生素等不通过抗体而直接导致PTR)、放化疗、移植物抗宿主病、血小板成分血质量问题(如储存损伤)等;免疫性因素包括HLA (human leukocyte antigen class I ,HLA-I)抗体、HPA (human platelet antigen,HPA)抗体、药物抗体、CD36抗体、自身抗体、ABO抗体等;混合因素是指非免疫因素和免疫因素混杂引起的PTR。部分输注无效患者有时难以区分究竟是免疫性还是非免疫性因素引起,一般以输注后1小时血小板计数的增加指标来反映免疫性因素引起的PTR,而18-24小时的血小板计数增加的指标来评价非免疫因素导致的PTR。根据欧美临床报道数据,一般认为单独的非免疫因素在PTR中约占40-80%,单独的免疫因素占10-30%,混合因素占10-30%。免疫因素中由于HLA抗体导致PTR发生率占25%-70%。
目前,对免疫性PTR无特效治疗,多依赖于血小板交叉配型,即选用无该抗体对应抗原的血小板进行输注,这不但对技术和设备有较高的要求,费时费力,造成患者住院时间延长、治疗费用增加,还常常难以找到相容的血小板。即使在发达国家,也仅有约31%的PTR患者能够找到配型相合的血小板进行输注。
免疫性PTR的发生主要与血小板表面抗原的分布有关,包括血小板特异性抗原(HPA);血小板相关抗原如人类白细胞抗原-I(HLA-I)和CD36抗原等。当血小板供者与患者之间的抗原不合时,血小板输注可诱导患者产生免疫应答,从而产生相应的抗体,引起临床血小板输注无效。由于引起免疫性PTR的因素中HLA-I类抗体占主要地位,下面我们就HLA-I类抗体引起的PTR的进展进行讨论。
医学领域关于由HLA-I类抗体引起PTR的研究已经取得了许多关键性的进展,主要包括以下几个方面:
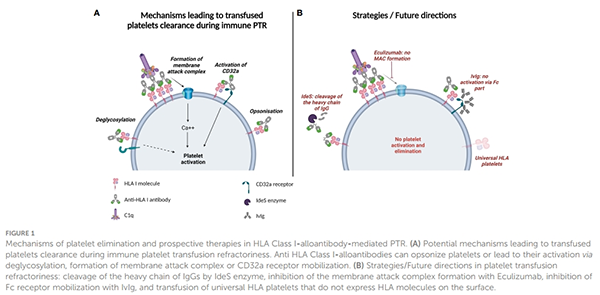
一:HLA-I类抗体可以促进致敏血小板被吞噬。由于抗体与抗原紧密结合,导致Fc受体的激活并引起吞噬作用,其中由IgG抗体引起的血小板被破坏主要发生在脾脏。
二:抗体介导的血小板清除也可以通过去唾液酸化来解释。在免疫性血小板减少症中, GPIbα抗体与GPIba亚基交联引起血小板激活以及激活相关信号通路。血小板活化导致颗粒分泌,随后释放CD62P和NEU 1,一旦去唾液酸化,血小板可被肝脏中Kupffer细胞清除。
三:HLA-I类抗体诱导的血小板活化同样可引起PTR。主要表现为HLA-I类抗体可以动员血小板细胞表面上表达的FcγRIIa/CD32a,FcγRIIa是具有基于细胞内免疫受体酪氨酸的活化基序(ITAM),其在通过IgG-免疫复合物交联时诱导ITAM磷酸化和随后的血小板活化。
四:抗体的糖基化主要影响其对FcR的亲和力和其动员补体的能力,抗人血小板抗原产生的抗体的岩藻糖糖基化程度低于总血清IgG1会导致IgG结合的血小板被吞噬,疾病严重程度增加。
HLA是高度多态性、共显性基因座位,目前已发现的HLA-A、B位点等位基因高达1.7万个,表达蛋白超过1万个(https://www.ebi.a c.uk/ipd/imgt/hla/about/statistics/),而目前可检出的HLA-A、B位点抗原/抗体仅为数百个,是某些同源性较高的HLA蛋白表达相同的抗原特异性,还是抗原抗体的交叉反应性导致某些HLA抗原/抗体尚未被鉴别和发现?这数百个HLA-A、B抗原在中国人群中的随机错配概率、抗原免疫原性强弱、随机输血的免疫风险及其对应抗体在中国人群PTR患者中的频率等数据均不明晰。因此,研究中国人群免疫性PTR患者的血小板抗体分布、抗原抗体特性,为我国献血者血小板抗原(基因)数据库建库和PTR患者的配合性输注提供应用性研究数据,将有助于进一步提升血小板配合性输注,从而提升血小板输注效果和血液安全水平。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9947338/
作者:任慧
校稿:夏文杰